
電話:
021-67610176傳真:
近日,一項刊登在雜志Nature上的研究報告中,來自美國國家癌癥研究所的科學家們通過研究對人體大型細胞通信網絡的兩大關鍵組分之間的相互作用進行了直觀性地研究,該研究有望幫助研究人員開發出治療偏頭痛和癌癥等一系列疾病的副作用較小的療法。
文章中,研究人員利用了一種新型的原子分辨率成像技術揭示了,名為視紫紅質的G蛋白偶聯受體(GPCR)能綁定到抑制性的G蛋白上,從而就為研究人員提供了一種藍圖,來設計高性的選擇藥物。研究者H. Eric Xu博士說道,闡明這種復合物的結構有望開啟分析GPCR故事缺失的一章,從而就能揭示這兩種分子是如何以一種精細化地方式相互作用的。
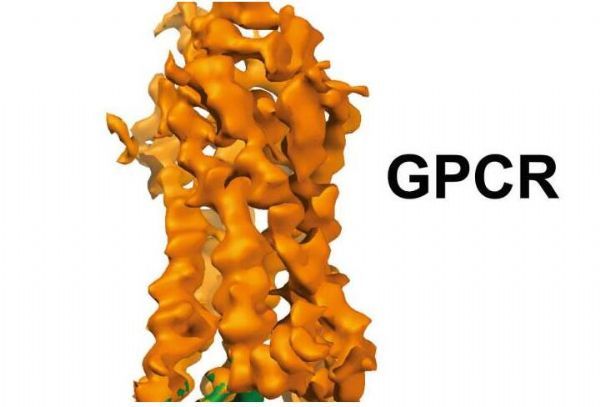
生物學中的一切都是基于分子間的相互作用,因此關于兩種分子的結構如何發揮作用,我們知道的越多,我們就越能掌握更多信息去改善并且開發副作用較小的藥物。如今研究人員的發現也基于使用了一種名為冷凍電鏡(cryo-EM)的技術,該技術能幫助科學家們更加清晰地觀察他們難以想象的分子。Sriram Subramaniam博士說道,利用冷凍電鏡技術獲得重要藥物靶點的結構信息,比如多種狀態下的GPCRs,這就說明如今研究人員可以利用這些方法用來發現新藥物了。
但嵌入細胞膜中時,GPCRs就能夠扮演細胞和其周圍環境之間的導線,同G蛋白和其它信號分子(比如抑制蛋白類)相互作用,傳遞來自細胞中的信號,從而調節機體的各種生理功能,包括生長、免疫反應和感官知覺。當與GPCRs連接起來后,抑制性G蛋白就能夠調節次級化學信號的產生,從而對全身產生效應,比如與大腦和腸道中的血清素受體相互作用來幫助調節機體的情緒和食欲;與大腦中的多巴胺受體相互作用,從而控制機體的獎懲反應和隨意運動等。
這種與G蛋白和抑制蛋白類的廣泛相互作用,以及隨時能夠移動到細胞外部,就使得GPCRs能夠作為研究人員開發多種新型療法的潛在靶點,目前市場上有30%以上的藥物都是通過與GPCRs相互作用來發揮作用的。研究者Yanyong Kang博士指出,我們的研究發現能夠幫助我們設計出新一代的藥物,這項研究中我們闡明了GPCR抑制性G蛋白復合體的特殊結構,而且我們相信這種方法能夠幫助我們有效描述難以可見的GPCRs的結構。
研究人員所開發的3D成像技術揭示了,位于抑制性G蛋白末端的特殊螺旋能夠扮演一種結構標記,從而幫助像視網膜紫質樣的GPCRs在抑制性G蛋白和另外一種激動型G蛋白之間進行分化。2015年發表在Nature雜志上的一篇研究報告中,研究人員就描述了視網膜紫質和抑制蛋白復合體的結構;隨后2017年刊登在Cell雜志上的研究報告中,研究人員Xu就和其同事進一步分析了視網膜紫質和抑制蛋白復合體的結構,同時還闡明了一系列磷酸化編碼或能指導GPCR-抑制蛋白復合體的組裝。
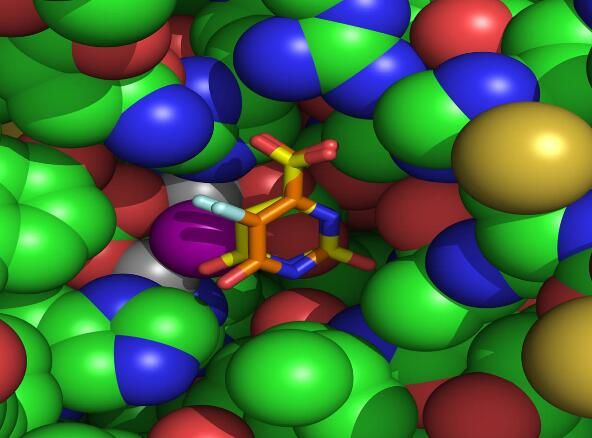
利用傳統的x射線晶體學技術很難對GPCRs可視化,截止到目前為止,在超過800個GPCRs中研究人員僅確定了40個GPCRs的結構,其中就包括研究者Xu發現的視網膜紫質和抑制蛋白復合體。為了進一步確定GPCRs的結構,研究人員利用了高強度的冷凍電鏡技術對類似GPCRs等分子進行了可視化的分析,后期研究人員還將利用這種技術進行更高分辨率分析,包括多個臨床相關的配體蛋白復合體的結構等。(生物谷)
參考資料:
【1】Cryo-EM reveals interaction between major drug targets
【2】Effects of a major drug target regulated through molecular “codes”
【3】Structural biology: Arresting developments in receptor signalling
Nature
【4】Cryo-EM structure of human rhodopsin bound to an inhibitory G protein
Nature