
電話:
021-67610176傳真:
近日,復旦大學生命科學學院遺傳工程國家重點實驗室朱煥章課題組設計并構建出只在HIV感染細胞上才能切除HIV-1前病毒的誘導型鋅指蛋白核酸酶(ZFN-Tat),避免了ZFN持續表達可能引起的潛在脫靶效應,為該技術在臨床上安全、有效地應用奠定了基礎。相關研究結果近日發表在期刊《Molecular Therapy- Nucleic Acids》;
抗逆轉錄病毒治療能顯著改善艾滋病患者的生存率,但該療法并不能治愈病人,其原因是抗病毒yao物僅能抑制復制,并不能對感染細胞基因組中HIV前病毒起作用,即“治標不治本”。因此,如何靶向清除整合在免疫細胞基因組上的HIV前病毒,是目前艾滋病治療研究領域zui富有挑戰性的科學問題;倘若能使整合的HIV前病毒從靶細胞基因組上缺失,那么,則可從根本上解決艾滋病不能治愈的問題,實現“斬草除根”的夢想。
目前,基于基因編輯技術的基因治療大約有20 多個方案進入臨床試驗,效果令人鼓舞,但其安全性問題仍需要考慮,譬如脫靶效應和免疫原性。2017 年 5 月 30 日,《自然•方法》(Nature Methods)報道了來自哥倫比亞大學等機構的研究人員發現,在治愈小鼠相關疾病遺傳性疾病的同時,基因編輯常用的工具 CRISPR/Cas9 可能會造成很多意料之外的基因突變。盡管,該文已撤稿,但技術本身的潛在脫靶效應是存在的。2018年1月,《自然》(Nature)報道了斯坦福大學Weinberg博士團隊的一項新研究,發現七成的健康人體內存在Cas9蛋白同源物抗體,近半數人具有Cas9蛋白同源物的抗原特異性T細胞。人體會對Cas9酶產生免疫反應,意味著人體自身的免疫系統可能會破壞基于CRISPR-Cas9開發的基因療法。Weinberg博士對此表示,Cas9只在短時間內開啟或表達,或者可以將Cas9進行重新設計使其不會引起免疫反應或抑制免疫系統本身。因此,開發有效性與安全性于一體的基因編輯技術是臨床應用的前提。
2013年,朱煥章教授課題組在上使用ZFN,成功切除了整合在基因組中的HIV-1前病毒。相關研究工作發表在了《Nucleic Acids Res》上,被《Nature Biotechnology》等雜志引用達到102次,是復旦大學2016年高被引文章之一。2017年,該技術已獲得國內shou個基因編輯技術在疾病上應用的授權。朱煥章教授課題組在此基礎上,利用反式激活因子Tat可與HIV-1調控區LTR上反式激活應答元件TAR結合以促進病毒的轉錄和復制的原理,設計并構建了以HIV-1調控區LTR為啟動子,通過反式激活因子Tat來調控ZFN的表達載體。由于Tat蛋白是HIV*的病毒蛋白,僅在HIV-1病毒感染的細胞表達,而Tat蛋白可與調控載體ZFN 上游調控區 TAR元件結合,可誘導ZFN表達,從而導致ZFN介導前病毒基因切除 。伴隨HIV-1前病毒的切除,Tat蛋白表達量將會減少,由此誘導的ZFN表達又恢復到背景水平,因而,可避免ZFN持續表達可能引起的潛在脫靶效應或免疫反應。將依賴Tat的ZFN表達載體轉染HIV病毒感染細胞,結果顯示大約30%感染細胞中HIV前病毒被切除(圖1B)。若轉染效率為100%的話,HIV前病毒被切除效率可達60%以上。
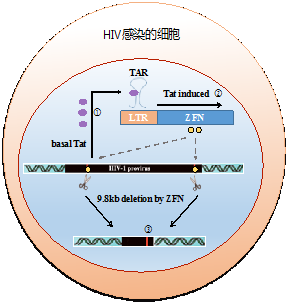

圖 ZFN在HIV-1感染的細胞中依賴Tat誘導全長前病毒切除。左圖為示意圖,右圖為ZFN表達載體轉染HIV病毒感染細胞后流式細胞儀檢測切除效率。
近幾年來,朱煥章課題組在艾滋病基因治療新型策略研究方面取得了階段性進展。利用基因編輯三大技術,除了前述靶向切除HIV前病毒外,也獲得了靶向抑制HIV或干預HIV潛伏的ZFP、TALE以及dCas9系統,證實了這些系統的有效性(Molecular Therapy, 2016, 508-521. Molecular Therapy- Nucleic Acids, 2017, 233-242).Gene Therapy ,2014,90-95;AIDS Res Hum Retroviruses,2015,98-106)。